|
 熱の移動 熱の移動
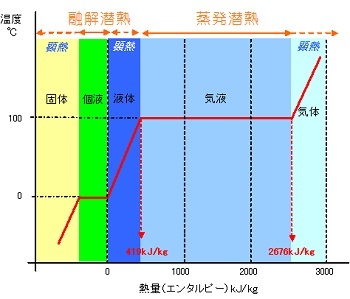
標準大気圧のもとでは固体である「氷」は加熱量に比例して温度上昇し、0℃になると溶け始め氷が溶け終わるまで温度は変わらない。氷が溶け終わると「水」の温度は再び加熱量に比例して上昇を始め、100℃に達すると沸騰して蒸発を行う。蒸発が終わるまでの水の温度は100℃一定で、蒸発を完了すると「水蒸気」の温度はさらに上昇を始める。
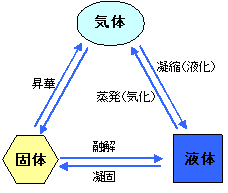
このように水は、熱量と比例して温度が変化する部分と、「固体から液体」、「液体から気体」へと相変化を起こし温度変化がない部分があり、前者を『顕熱変化』、後者を『潜熱変化』と呼ぶ。
|
|
顕熱と潜熱
物質は、原子や分子で構成されている。水は、氷の状態も、蒸気の状態も、化学記号ではH2Oである。固体である氷は通常6方晶系の氷結晶であり、各分子はお互いに引力で引き合っており、また、各分子は運動(熱振動)を行っている。このときの分子の運動は、温度に比例して絶対零度(0K)では動きが全てなくなり停止し、熱はなくなる。氷が溶けて水になると分子構造は全く変わり、氷結晶のような明瞭な規則性はなくなり、動きの自由度が大きくなる。更に温度が上昇して蒸発して水蒸気になると水分子の運動は一層激しくなり空気中に飛び出して拡散していく。
すなわち「温度」とは、物質の分子等の運動エネルギーを表す尺度であり、ひいては物質の保有する熱量を表している。このような熱を「顕熱」という。また「氷が溶けるとき」、「水が沸騰・蒸発するとき」のように、熱が加えられても温度変化が生じない熱を「潜熱」という。潜熱は氷から水、水から蒸気のように、相変化に伴って生ずる熱であり、物質を構成している分子等を結合している引力(ポテンシャルエネルギー)に基づくものである。
顕熱・潜熱 別の説明
|

 熱の移動
熱の移動