温度をともなって起こる体積変化
|
 液体の体積変化 液体の体積変化
普通の液体では、温度が上昇するとともに体積はほぼ一定の割合で増加する。
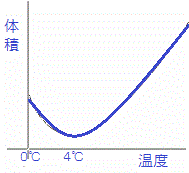
水の体積変化
水はちょっと特殊な液体で、0℃から4℃までは温度の上昇とともに体積が減少する。そして4℃から温度が高くなるにつれて体積は増加していく。この様子を簡単なグラフに示すと右のようになり、同じ重さの水で比べたとき、4℃の水が最も体積が小さいことになる。この体積が最少の水1000cm3の重さを1kgとするのが、今のキログラムの定義のもとになったものである。
水から氷になるときも体積の変化が見られる。氷になると、体積はおよそ1.1倍になる。これにより、膨張して軽くなった氷は水に浮く。
水から水蒸気になるときは、体積は非常に大きくなる。この膨張(ぼうちょう・体積が大きくなること)の力を利用したのが蒸気機関である。
|
|
|
熱しにくく 冷めにくい
|
人間の体内に流れる水の役割は、物質を溶かして運搬するだけではない。体温を保つという役割もある。
これは、水の「熱しにくく さめにくい」という特性からで、水の「比熱容量が高い」ことによるもの。比熱容量とは、物質の温度を上昇させるのに必要なエネルギーのことで、単位は「カロリーまたはジュール」で表す。水の場合、重量1グラムを1℃上昇させるのに約1カロリーを要する。ところがほかの溶液はこの半分ですむ。
比熱容量の低い物資は、鉄のように「熱しやすく 冷めやすい」ものだから、もし水が比熱容量の低い物質だったら人間の体温は気温によって簡単に左右され乱高下するだろう。すなわち、比熱容量が高いことは「エネルギーを貯めて置きやすい」ことを意味する。
【1カロリー≒4.186ジュール】
|
|
 地球には約14億km3の水があると言われてる。この内、約97%が海水で、淡水は3%だけ。この淡水の大部分は北極や南極にある氷となっているから、私たちが利用することができる川・湖の水や地下水は地球上の水のわずか0.3%に過ぎない。
地球には約14億km3の水があると言われてる。この内、約97%が海水で、淡水は3%だけ。この淡水の大部分は北極や南極にある氷となっているから、私たちが利用することができる川・湖の水や地下水は地球上の水のわずか0.3%に過ぎない。 水は生物の主要成分であり、生物の重さの60〜80%は水の重さである。
水は生物の主要成分であり、生物の重さの60〜80%は水の重さである。
 液体の体積変化
液体の体積変化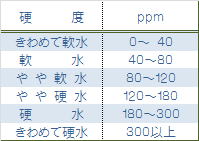 の反応で沈殿するため、除くことがでる。
の反応で沈殿するため、除くことがでる。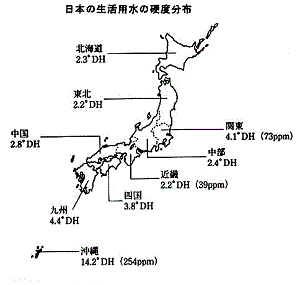
 ミネラルとは体の機能の維持・調節に必要不可欠な栄養素である。人の体の95%は有機物(酸素、炭素、水素、窒素)で構成されており、残りの5%が無機物・鉱物であるミネラルである。
ミネラルとは体の機能の維持・調節に必要不可欠な栄養素である。人の体の95%は有機物(酸素、炭素、水素、窒素)で構成されており、残りの5%が無機物・鉱物であるミネラルである。
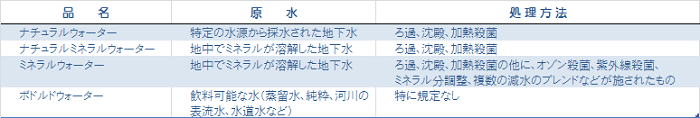
 よく耳にする「酸性」と「アルカリ性」。これを表す単位を「pH(ペーハー)」と言う。
よく耳にする「酸性」と「アルカリ性」。これを表す単位を「pH(ペーハー)」と言う。